O nouă etapă în studiile clinice din România
principalul subiect de dezbatere în cadrul unui eveniment dedicat membrilor presei
Cu obiectivul principal de a informa corect publicul larg despre importanța studiilor clinice, workshopul dedicat jurnaliștilor „Studiile clinice în domeniul medicamentelor de uz uman. Acces la medicamente de ultimă generație pentru pacienții români. Desființarea miturilor” a reunit joi, 6 aprilie 2023, reprezentanți ai celor mai importante instituții implicate în reglementarea, implementarea și desfășurarea cercetării medicale și a studiilor clinice în România.
În cadrul evenimentului au fost abordate mai multe teme de interes, cu scopul de a demitiza unele dintre cele mai frecvente preconcepții despre ce înseamnă studiile clinice și, de asemenea, de a prezenta care sunt beneficiile reale ale acestora.
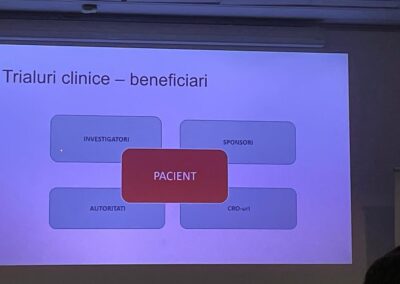
„Studiile clinice aduc beneficii tuturor actorilor implicați, respectiv pacienți, medici, industria farmaceutică și, nu în ultimul rând, statului român”, după cum a explicat Directorul executiv al Asociației Române a Producătorilor Internaționali de Medicamente (ARPIM), Dan Zaharescu. El precizează că acestea reprezintă un factor care poate să sprijine foarte mult cercetarea medicală și progresul în domeniul medicinei.
„În primul rând beneficiază pacienții, pentru că au acces la medicamente care sunt extrem de moderne și care pot să îi ajute atunci când niciun alt medicament nu-i poate ajuta. Ei nu sunt <cobai de laborator>, unul dintre miturile eronat asociate studiilor clinice, ci acestea pot fi sau chiar sunt singura lor șansă ca să supraviețuiască și să beneficieze totuși de un produs care ar putea să le salveze viața. În același timp, beneficiază și de investigații care sunt făcute gratuit pentru ei, sunt realizate pe banii celor care finanțează studiile clinice, ale sponsorilor. Pe de altă parte, sistemul de sănătate beneficiază și el, pentru că pacienții care sunt implicați în studiile clinice nu mai sunt în finanțarea sistemului, ci în cea a sponsorilor. În plus, medicii investigatori au și ei acces la cele mai moderne și cele mai noi informații din domeniul medical, la echipamente moderne și toate acestea duc la creșterea gradului lor de pregătire”, a încheiat Dan Zaharescu.
Managerul Centrului de Oncologie „Sfântul Nectarie” din Craiova și Președintele comisiei de Oncologie din cadrul Ministerului Sănătății, doctorul Michael Schenker a vorbit despre pacienții deja înrolați în astfel de studii. El a punctat faptul că, din anul 2014 și până în prezent, la centrul pe care îl conduce au fost tratați, cu ajutorul trialurilor clinice, peste 130 de pacienți cu cancer pulmonar, o formă considerată „greu de tratat” între diferitele tipuri ale acestei boli. „Sunt peste 130 de pacienți pe care îi avem în evidență, tratați în aceste trialuri clinice începând cu 2014. Și care au între 5 și 9 ani de la diagnosticul bolii metastatice și care sunt în viață, iar mulți dintre ei nu mai au niciun semn de boală. Cu alte cuvinte, aceste terapii noi au adus ceea ce aveam ca nevoie de mult timp, un tratament foarte eficient care poate să vindece boala inclusiv în stadii foarte avansate”.
Un alt beneficiu subliniat în cadrul evenimentului a fost cel referitor la accesul pacienților la studii clinice care conțin terapii noi ce țintesc astăzi cauza bolii și nu simptomele, așa cum se întâmpla în urmă cu 20-30 de ani.
„Acest acces, în contextul studiilor clinice, vine să discute despre progresul tehnologic, despre diagnosticul din ce în ce mai precis care este acum molecula, care este acum genetic și care înseamnă de fapt abilitatea de a produce soluții, medicamente care să țintească precis, să fie mai eficiente decât orice înainte. În realitate, condiția cercetărilor studiilor clinice de astăzi se duce către reversarea cursului natural al bolii. Dacă stați o secundă și vă gândiți la soluțiile terapeutice de acum 20-30 de ani, ele ținteau simptome”, a susținut, la rândul său, Radu Rășinar, președintele Asociației Local American Working Group (LAWG).
El a subliniat și importanța participării și integrării cercetătorilor români în comunitățile internaționale de profil prin implicarea în acest studii, pentru informare la zi, dezvoltare și adăugarea de valoare în cercetarea medicală locală.
„Studiile clinice sunt sigure, benefice și voluntare”, a declarat prof. Univ. Dr. Farm. George Burcea, expert Direcția Studii Clinice a Agenției Naționale a Medicamentului și a Dispozitivelor Medicale din România, argumentând că „studiile clinice sunt sigure deoarece sunt reglementate la nivel național, european, internațional. Ele sunt controlate, pe de-o parte de către agenție, pe de altă parte de către Comisia de Bioetică”, iar toți participanții în studiul clinic intră pe bază de voluntariat după ce semnează un consimțământ informat, cu toate etapele explicate pe înțelesul lor.
„De asemenea, e important de precizat că un participant într-un studiu clinic se poate retrage în orice moment. Deci dacă azi se hotărăște că vrea să intre într-un studiu clinic și până a ajuns acasă s-a răzgândit din orice motiv, el are dreptul să se retragă. Nu este obligatoriu să participe într-un studiu clinic, dacă nu își dorește”.
Președintele Agenției Naționale a Medicamentului și a Dispozitivelor Medicale din România (ANMDMR) Dr. Farm. Răzvan Prisada a explicat, la rândul său, care sunt temerile des întâlnite în rândul pacienților.
„Principala temere, dacă îmi permiteți să o sintetizez așa, este: <Sunt studiile clinice tratamente sau <experimente> pe oameni?>. Și întâlnirea de astăzi a avut, printre alte scopuri, fix acesta. De a demonstra, de a arăta cu cifre și exemple diferite, chiar de la pacienții care au fost înrolați și au făcut parte din studii clinice, că vorbim de o șansă. Vorbim de pacienți cărora acum câțiva ani li se dădea o speranță de viață de două luni și care au fost astăzi alături de noi. Vorbim, de asemenea, de un acces timpuriu, înainte de autorizarea formală care poate dura ani, mai ales pentru pacienții cu afecțiuni care nu le acordă suficient de mult timp pentru a aștepta o autorizare propriu-zisă.”
Workshopul susținut în prima parte a lunii aprilie este prima acțiune de informare a publicului despre domeniul și importanța studiilor clinice, ca parte a parteneriatul strategic încheiat în aceeași lună între șase instituții reprezentative din domeniul cercetării medicale din România, pentru dezvoltarea studiilor clinice în România.
Agenția Națională a Medicamentului și a Dispozitivelor Medicale din România (ANMDMR), Comisia Națională de Bioetică a Medicamentului și a Dispozitivelor Medicale (CNBMDM), Universitatea de Medicină şi Farmacie „Carol Davila” din București, Asociația Companiilor Conducătoare de Studii Clinice din România (ACCSCR), Asociația Română a Producătorilor Internaționali de Medicamente (ARPIM) și Asociația Local American Working Group (LAWG) au semnat pe 4 aprilie 2023 un semnat un acord prin care se dorește ca România să devină un partener important al cercetării medicale la nivel european și global.
Acest parteneriat se aliniază unui context favorabil de dezvoltare creat de intrarea în vigoare, începând din ianuarie 2022, a Regulamentului European privind studiile clinice (Regulamentul UE Nr. 536/2014) în statele membre ale Uniunii Europene. Prin introducerea acestuia, cercetarea medicală din cadrul studiilor clinice a intrat într-o perioadă caracterizată de multiple schimbări benefice, care implică un nou tip de abordare și o coordonare mult mai flexibilă și mai rapidă a activităților de acest tip, la nivel european.
Workshopul susținut în prima parte a lunii aprilie este prima acțiune de informare a publicului despre domeniul și importanța studiilor clinice, ca parte a parteneriatul strategic încheiat în aceeași lună între șase instituții reprezentative din domeniul cercetării medicale din România, pentru dezvoltarea studiilor clinice în România.
Agenția Națională a Medicamentului și a Dispozitivelor Medicale din România (ANMDMR), Comisia Națională de Bioetică a Medicamentului și a Dispozitivelor Medicale (CNBMDM), Universitatea de Medicină şi Farmacie „Carol Davila” din București, Asociația Companiilor Conducătoare de Studii Clinice din România (ACCSCR), Asociația Română a Producătorilor Internaționali de Medicamente (ARPIM) și Asociația Local American Working Group (LAWG) au semnat pe 4 aprilie 2023 un semnat un acord prin care se dorește ca România să devină un partener important al cercetării medicale la nivel european și global.
Acest parteneriat se aliniază unui context favorabil de dezvoltare creat de intrarea în vigoare, începând din ianuarie 2022, a Regulamentului European privind studiile clinice (Regulamentul UE Nr. 536/2014) în statele membre ale Uniunii Europene. Prin introducerea acestuia, cercetarea medicală din cadrul studiilor clinice a intrat într-o perioadă caracterizată de multiple schimbări benefice, care implică un nou tip de abordare și o coordonare mult mai flexibilă și mai rapidă a activităților de acest tip, la nivel european.